牟琦, 陶志嵩,刘加成, 冯雪凤
(1.东南大学附属中大医院 核医学科, 东南大学江苏省分子影像与功能影像重点实验室,东南大学 医学院,江苏 南京 210009; 2.南京大学医学院附属鼓楼医院 核医学科,江苏 南京 210008)
格雷夫斯甲状腺功能亢进症(以下简称甲亢)是一种持续合成和分泌过多甲状腺激素引起的自身免疫性疾病[1-2]。甲状腺激素广泛影响物质的合成代谢和分解代谢,分泌过量时促进分解代谢的作用更明显。甲亢的治疗方法主要包括131I、药物和手术[1,3],药物治疗成功率仅50%,治疗持续时间长,不良反应发生率高,复发比例高;手术疗效确切,但为有创性操作;131I 治疗相比其他2种治疗方法具有疗效好、不良反应少、起效迅速的优势。口服131I以后,2~4周甲状腺组织会出现水肿、变性等系列改变, 2~3个月出现滤泡上皮脱落、纤维组织增生等,治疗成功率(93%)仅次于手术治疗(99%),不良反应发生率仅为 6%[1],但治疗后甲减发生率较药物治疗高,由甲减引起的高脂血症会导致心血管疾病的风险增加。本研究探讨131I治疗后物质代谢变化,评估甲亢131I治疗后各指标变化利弊,为甲亢的临床诊疗提供参考。
1.1 一般资料
选取2020年1月至2021年10月南京鼓楼医院核医学科连续收治并行131I治疗的127例甲亢患者,年龄(39.38±12.55)岁,男44例,女83例,131I治疗剂量为(341.25±69.58)MBq。纳入标准:(1) 符合我国《131I治疗格雷夫斯甲亢指南(2021版)》中甲亢的诊断标准[1];(2) 临床资料完整,符合本次研究要求;(3) 未服用影响血脂的药物。排除标准:(1) 非格雷夫斯病引起的甲亢者;(2) 高血糖、高血脂及肾病病史者;(3) 伴恶性肿瘤及其他器质性疾病者。本研究方案已获得南京鼓楼医院伦理委员会批准,该回顾性研究已免除患者知情同意。
1.2 方法
1.2.1 血标本采集 所有研究对象采血前禁食12 h,未服用对血糖、血脂、蛋白质代谢有影响的药物。抽取患者静脉血2管,每管3 ml,自然凝固后离心分离血清上机检测。
1.2.2 指标测定 测定患者治疗前及治疗3个月后的血清促甲状腺激素(thyroid stimulating hormone,TSH)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)、甲状腺球蛋白抗体(thyroglobulin antibody,ATG)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAB)、促甲状腺激素受体抗体(thyrotropin receptor antibody,TRAB)、促甲状腺素免疫球蛋白(thyroid stimulating immunoglobulin,TSI)、甘油三酯(triglyceride,TG)、胆固醇(cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、载脂蛋白A(apolipoprotein A,APOA)、载脂蛋白B(apolipoprotein B,APOB)、血糖(glucose,Glu)、肌酐(creatinine,Cr)和尿素氮(BUN)水平。甲状腺功能(简称甲功)采用美国Roche Elecsys化学分光仪检测。所有检测严格按照说明书操作步骤进行,所有试剂均为美国Roche公司供应的仪器配套试剂。血糖、血脂、BUN、Cr水平采用日本Olympus AU400全自动生化分析仪器及其配套的试剂盒测定。正常参考值:TSH 0.27~4.2 mIU·L-1,FT3 3.1~6.8 pmol·L-1,FT4 12~22 pmol·L-1,ATG 0~115 IU·ml-1,TPOAB 0~34 IU·ml-1,TRAB 0~1.75 IU·L-1,TSI<0.55 IU·L-1,TG 0.56~1.7 mmol·L-1;TC 2.9~5.72 mmol·L-1,HDL-C 0.94~2 mmol·L-1,LDL-C 1.89~3.1 mmol·L-1,APOA 1~2.05 mmol·L-1,APOB 0.6~1.2 mmol·L-1,BUN 2.9~7.5 mmol·L-1,Glu 3.9~6.1 mmol·L-1,Cr 44~106 μmol·L-1。
1.2.3 疗效评估 疗效评估符合我国《131I治疗格雷夫斯甲亢指南(2021版)》[1]标准。(1) 甲功正常:甲亢症状和体征完全消失,血清FT4 水平恢复正常;(2) 甲功减退:出现甲减症状和体征,血清FT4水平低于正常;(3) 甲亢好转:血清FT4水平降低,但未恢复正常;(4) 甲亢反弹:血清FT4水平进一步升高。
1.3 统计学处理
采用SPSS 26.0统计软件进行数据处理。正态分布的连续变量(FT3、FT4、TG、TC、HDL-C、LDL-C、APOA、APOB、131I剂量和年龄)采用均数±标准差表示,治疗前后的比较采用配对t检验;非正态分布的计量资料(ATG、TPOAB、TRAB、TSI和病程)用M(Q1、Q3)表示,使用Mann-WhitneyU检验进行分析。使用卡方检验分析分类变量(高脂血症)。不同疗效各组间年龄的比较采用方差分析。对不同疗效各组间甲减人数进行加权,使用费舍尔精准检验分析各组血脂异常比例。体重、甲状腺激素与血脂之间的相关性采用Pearson和Spearman相关分析。P<0.05为差异具有统计学意义。
2.1 治疗前后各指标比较
131I治疗后FT3、FT4、BUN、Glu较治疗前明显下降(P<0.01),FT3由(26.31±13.10) pmol·L-1降至(6.51±1.53) pmol·L-1,FT4由(65.12±27.80) pmol·L-1降至(18.97±11.95) pmol·L-1;TG、TC、HDL-C、LDL-C、APOA、APOB、Cr较治疗前明显升高(P<0.01),见表1、2。TG偏高者由治疗前的19例升至治疗后的29例(P<0.001),TC偏高者由治疗前的1例升至治疗后的38例(P<0.001),LDL-C偏高者由治疗前的6例升至治疗后的49例(P<0.001)。

表1 治疗前后甲功及Glu、BUN、Cr变化
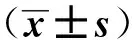
表2 治疗前后血脂变化 mmol·L-1
2.2 治疗后各组人数分布及年龄比较
根据131I治疗后3个月甲功的结果将患者分为4组,甲功减退组64例,年龄(40.86±12.27)岁,甲功正常组27例,年龄(39.41±12.71)岁,甲亢好转组21例,年龄(38.81±11.17)岁,甲亢反弹组15例,年龄(33.80±14.78)岁,4组患者年龄差异无统计学意义(P>0.05)。
2.3 各组甲功及Glu、BUN、Cr治疗前后变化
甲功减退组、甲功正常组、甲亢好转组治疗后的FT3、FT4均较治疗前下降,TSH较治疗前升高(P<0.01);甲亢反弹组治疗后的FT3、FT4较治疗前升高(P<0.05);甲功减退组、甲功正常组BUN、Glu较治疗前下降(P<0.05);甲功减退组、甲功正常组、甲亢好转组Cr较治疗前升高,甲亢反弹组Cr较治疗前下降(P<0.01)。见表3。
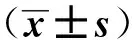
表3 各组甲功及Glu、BUN、Cr治疗前后变化
2.4 各组血脂治疗前后变化
甲功正常组、甲功减退组、甲亢好转组TC、HDL-C、LDL-C、APOA、APOB较治疗前明显升高(P<0.05),其中甲功减退组LDL-C由(1.86±0.58) mmol·L-1升至(3.42±1.03) mmol·L-1,TG由(1.06±0.56) mmol·L-1升至(1.42±1.12) mmol·L-1;甲功正常组LDL-C由(1.99±0.72) mmol·L-1升至(2.89±0.63) mmol·L-1;甲亢反弹组治疗前后血脂差异无统计意义(P>0.05)。由甲功减退组和甲功正常组治疗前后血脂变化可见,随FT3、FT4下降,血脂随之升高。见表4。
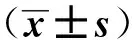
表4 各组血脂治疗前后变化 mmol·L-1
2.5 甲功正常组与甲功减退组临床资料的比较
甲功减退组高脂血症的发生率显著高于甲功正常组(P=0.023);甲功减退组与甲功正常组比较,131I剂量,年龄,病程,性别,治疗前FT3、FT4、ATG、TPOAB、TRAB、TSI水平差异均无统计学意义(P>0.05)。见表5。
根据FT4水平将甲减患者分为0 表6 4组甲减患者血脂异常的比较 例 体重变化与TC、HDL-C、LDL-C、APOA、APOB变化呈正相关(P<0.01),FT3、FT4变化与TG、TC、HDL-C、LDL-C、APOA、APOB变化呈负相关(P<0.05),见表7。 表7 治疗前后体重、甲功变化与血脂变化相关性分析 甲状腺激素是维持机体功能活动的重要激素,几乎涉及所有器官[4],从多方面调节物质代谢与生长发育,生物效应十分广泛。研究发现,甲亢时基础代谢率可提高达60%~80%,甲减时基础代谢率降低。甲状腺激素在脂质代谢中起着重要作用,包括脂质的消化、运输、生物合成和分解代谢[5]。 高脂血症的发生率随着年龄的增加而增加。本研究结果显示,4组的年龄差异无统计学意义,排除了年龄对血脂的干扰。研究发现,脂质与FT3、FT4呈负相关,TC、HDL-C、LDL-C、APOA和APOB随FT3、FT4的降低而增加。 羟甲基戊二酰辅酶A还原酶(HMG-CoA)是LDL合成中的限速酶[6]。甲状腺激素诱导肝细胞中HMG-CoA还原酶的表达,进而促进胆固醇合成[7]。然而,甲状腺激素也会增加肝脏、成纤维细胞和其他组织中LDL-C受体(LDLR)的表达,LDLR有利于清除血清中的LDL胆固醇[8]。甲状腺激素对LDLR表达的影响超过了促进肝脏胆固醇合成的影响,导致甲亢患者胆固醇降低,甲减患者血清LDL胆固醇净累积[8]。另一项研究[9]表明,甲状腺激素的关键作用包括胆固醇酯转运蛋白和脂蛋白脂酶的增加,以及前蛋白转化酶枯草杆菌毒素-9(PCSK-9)的减少。血浆PCSK9与LDLR结合,促进其降解[10],导致甲减患者TC、LDL-C和TG升高。 HDL是高度异质的,由不同大小、不同密度、不同浓度的亚种组成[11]。Van Der Boom等[12]招募了17例在分化型甲状腺癌患者中因接受全甲状腺切除术导致严重短期甲状腺功能减退的患者,并研究了其HDL颗粒的特征,观察到HDL功能受损,胆固醇流出减少。APOA和APOB也受甲状腺激素的影响。APOA是高密度脂蛋白的主要成分,其缺乏导致心血管疾病(CVD)风险增加[13]。APOB是比LDL-C更强的致动脉粥样硬化指标[14]。血脂增加可能会导致心血管疾病风险升高。研究[15]表明,虽然TC、LDL-C和APOB在甲状腺功能减退症中升高,但补充左旋甲状腺素(L-T4)可以逆转这种升高,从而使CVD的风险降低。 本研究结果显示,甲功减退组高脂血症的比例高于甲功正常组(P=0.023),并进一步比较了两组的131I剂量、年龄、病程、性别以及治疗前FT3、FT4、ATG、TPOAB、TRAB、TSI水平,两组之间差异无统计学意义。治疗效果的差异可能归因于患者对131I的敏感性及药物在体内的有效半衰期不同。通过比较4组的血脂发现甲功减退组的血脂最高,TC 及 LDL-C升高可能是CVD及青年发生高血压的危险因素之一[16]。进一步比较不同FT4水平甲减患者血脂异常比例,发现当FT4≤6 pmol·L-1时高胆固醇血症比例明显增加。体重的变化与TC和LDL-C的变化中度相关,可以通过体重的变化预测TC、LDL-C的变化,减少因甲减继发高脂血症导致心脑血管疾病的发生。 当甲亢转变为甲功正常或甲功减退时,Glu显著降低。甲状腺激素介导细胞代谢的许多方面,如胰岛素信号传导、脂肪生成、糖异生、细胞增殖和凋亡。Yan等[17]发现在甲状腺功能减退小鼠接受T3治疗5 d后,伴随着胰高血糖素样肽-1(GLP-1)产生,胰岛素分泌增加,葡萄糖代谢改善。 BUN、Cr是肾功能最常见的指标,甲状腺激素影响肾脏发育、肾脏血流动力学、肾小球滤过率和水电解质代谢[18-19]。甲状腺机能减退和甲状腺机能亢进通过影响心血管功能和肾血流动力学来影响肾功能[19-20]。与甲状腺功能减退相关的肾损害被认为是心输出量减少以及肾血流量和GFR降低的结果[19]。研究表明,甲状腺功能减退症患者肌酐升高[18, 21-23],甲状腺功能亢进症患者肌酐降低。然而,补充L-T4后,其迅速恢复正常[24]。在本研究中,当病情转为甲状腺功能减退、甲状腺功能正常或甲状腺功能亢进改善时,Cr显著增加,但仍保持在生理水平。甲亢是一种代谢性疾病,患者基础代谢率增加,体重降低,而Cr浓度反映患者的肌肉质量[25],体内肌肉含量的减少导致甲亢反弹组的Cr低于生理水平。 当甲状腺激素过多时,ROS和脂质过氧化产物增加,超过抗氧化系统的清除能力,从而导致肾细胞损伤和BUN增加[26]。一旦甲亢得到控制,与治疗前相比,氧化应激反应减轻,自由基和尿素氮生成减少。 131I治疗后FT3、FT4指标显著改善,Glu、BUN和Cr等指标明显好转;随FT3、 FT4下降血脂随之升高,特别是甲功减退组,当体重增加或FT4≤6 pmol·L-1时,需警惕发生高脂血症,减少因高脂血症导致CVD风险升高带来的不利影响。
2.6 治疗前后体重、FT3、FT4变化与血脂变化的相关性分析

3.1 对血脂的影响
3.2 对血糖的影响
3.3 对BUN、Cr的影响
