汤 涛,陈 曦,陈铜兵,王 辉
(江苏省常州市第一人民医院病理科,江苏 常州 213003)
肺癌作为全球范围内的最常见的病死率最高的恶性肿瘤之一,据统计,全球每年新发肺癌患者约120万例。2015年流行病学显示,中国肺癌发病例数高达73万例,死亡例数高达61万[1]。近年来,随着精准医疗的提出和发展,靶向治疗,免疫治疗及放化疗已经成为癌症治疗的重要手段,其中以表皮生长因子受体(epidermal growth factor receptor,EGFR)为靶点的人表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)为EGFR基因敏感突变的非小细胞肺癌患者带来巨大的临床获益[2]。循环肿瘤DNA(circulating tumor DNA,ctDNA)是由肿瘤细胞释放到循环血液中的DNA。研究表明,患者ctDNA所携带的肿瘤突变信息与肿瘤组织具有良好的一致性,ctDNA已经成为肿瘤特异性敏感标志物[3]。ctDNA在肿瘤辅助诊断和预后检测都具有很好的作用。近年来,随着聚合酶链反应(polymerase chain reaction,PCR)技术的发展,数字聚合酶链反应(droplet digital polymerase chain reaction,ddPCR)技术已被用于非小细胞肺癌患者ctDNA中EGFR突变的检测。然而,对ddPCR的临床应用以及临床意义的研究有限。因此,本研究旨在明确ddPCR技术在ctDNA中检测EGFR的临床意义。报告如下。
1.1一般资料 收集2016年1月—2017年12月在苏州大学附属第三医院胸外科及呼吸科住院治疗的肺腺癌的血液样本,男性54例,女性48例,年龄32~83岁,平均(63.0±1.2)岁;
有吸烟史65例。入选标准:①经病理诊断为肺腺癌;
②组织学样本已经确定EGFR基因突变状态;
③采血前患者未接受过任何治疗;
④CT评估原发病灶大小。用ddPCR对血样样本行EGFR基因21号外显子L858R(EGFR-L858R)和19外显子缺失(EGFR-19del)突变检测,引物序列如下:19ex-Fi:5′-GTGACGTAC-TAGCAACGTGCCAGTTAACGTCTTCCTTCT-3′;
19ex-Ri:5′-TAGCAGGATACGACTATCACA-CAGCAAAGCAGAAATCTAC-3′;
21ex-Fi:5′-GTGACGTACTAGCAACGACAGCAGGGTCTT-CTCTGTTTC-3′;
21ex-Ri:5′-TAGCAGGATACG-ACTATCTGACCTAAAGCCACCTCCTTAC-3′。
1.2血浆收集和DNA提取 Streck管收集患者血液,2 h内3 000 r/min离心10 min,重复离心1次,分离上清,-80 ℃保存。ctDNA提取采用QIAamp DNA Blood Mini kitDNA提取试剂盒,严格按照说明书操作。
1.3ddPCR ddPCR严格按照仪器操作手册(Bio-Rad,CA,USA)进行。在检测EGFR-L858R和EGFR-19del时。首先使用QX100液滴发生器(Bio-Rad)形成液滴。然后使用热循环器(Bio-Rad)对每个液滴进行PCR扩增。PCR后,液滴在QX200液滴读取器(Bio-Rad)上逐条分流,通过荧光计数来判断目标DNA浓度。使用QuantaSoft软件(Bio-Rad)进行数据分析,一般要求滴数>8 000的数据才用于分析。
1.4统计学方法 应用SPSS 23.0统计软件分析数据。计量资料比较采用独立样本t检验和单因素方差分析。绘制受试者工作特征曲线(receiver operator characteristic curve,ROC曲线),分析ddPCR技术检测ctDNA中EGFR突变的价值。采用Spearman相关分析检验两个变量之间的相关性。使用Kaplan-Meier方法生成生存曲线。P<0.05为差异有统计学意义。
2.1ddPCR技术预测患者真实的EGFR突变状态 102例肺腺癌患者,T分期:T1 29例,T2 26例,T3 13例,T4 32例;
N分期:N0 49例,N1 2例,N2 23例,N3 27例;
M分期:M0 60例,M142例;
病理分期:Ⅰ期患者32例,Ⅱ期8例(7.4%),Ⅲ期18例,Ⅳ期44例;
EGFR突变类型:EGFR基因野生型40例,EGFR-L858R突变型32例,EGFR-19del突变型26例,EGFR其他类型突变4例。绘制受试者工作特征曲线(receiver operator characteristic curve,ROC)分析ddPCR技术检测ctDNA中EGFR突变评价患者真实的EGFR突变状态,结果显示,在区分EGFR基因不同突变类型情况下,EGFR-19del曲线下面积(area under the curve,AUC)为0.652(95%CI:0.557~0.774)(图1A),EGFR-L858R的AUC为0.646(95%CI:0.534~0.796)(图1B)。ddPCR技术用于检测ctDNA中EGFR-19del和EGFR-L858R突变的敏感度分别为41.5%和39.8%,特异度分别为91.0%和96.5%。此外,在不区分EGFR基因突变类型情况下,ddPCR技术检测ctDNA中EGFR突变能否用于评价患者EGFR突变状态,显示AUC为0.694(95%CI:0.592~0.793),敏感度为40.2%,特异度为88.6%(图1C)。

图1 ddPCR技术预测ctDNA中EGFR突变的ROC曲线A.EGFR-19del曲线Ⅰ~Ⅳ;B.EGFR-L858R曲线Ⅰ~Ⅳ;C.不区分EGFR突变类型Ⅰ~ⅣFigure 1 ROC curve of ddPCR in predicting EGFR mutation in ctDNA
2.2ctDNA预测晚期肺腺癌中具有较高的敏感度和特异度 Ⅰ~ⅢA定义为早期肺癌,ⅢB~Ⅳ定义为晚期肺癌。在早期肺癌患者中,ddPCR技术检测ctDNA中EGFR突变,EGFR-19del的AUC为0.417(95%CI:0.431~0.537),敏感度为0%,特异度为92.1%(图2A),EGFR-L858R的AUC为0.521(95%CI:0.383~0.636),敏感度为11.0%,特异度为100.0%(图2B)。不区分EGFR-19del和EGFR-L858R类型,ddPCR技术检测早期患者ctDNA中EGFR突变显示,AUC为0.498(95%CI:0.392~0.614),敏感度为10.2%,特异度为100.0%(图2C);
在晚期肺癌患者中,EGFR-19del的AUC为0.854(95%CI:0.715~0.976),敏感度为76.7%,特异度为90.1%(图2D),EGFR-L858R的AUC为0.768(95%CI:0.642~0.957),敏感度为63.4%,特异度为96.8%(图2E)。不区分EGFR-19del和EGFR-L858R类型,ddPCR技术检测晚期患者ctDNA中EGFR突变显示,AUC为0.837(95%CI:0.751~0.936),敏感度为75.2%,特异度为85.1%(图2F)。综上所述,ddPCR技术用于预测晚期肺癌患者EGFR突变与组织有更高的一致性,说明ddPCR技术检测ctDNA中EGFR突变更适用于晚期肺癌患者。

图2 ddPCR技术预测ctDNA中EGFR突变的ROC曲线A.EGFR-19del曲线Ⅰ~ⅢA;B.EGFR-L858R曲线Ⅰ~ⅢA;C.不区分EGFR突变类型Ⅰ~ⅢA;
D.EGFR-19del曲线ⅢB~Ⅳ;E.EGFR-L858R曲线ⅢB~Ⅳ;F.不区分EGFR突变类型ⅢB~ⅣFigure 2 ROC curve of ddPCR in predicting EGFR mutation in ctDNA
2.3血浆ctDNA可作为预测远处转移的替代标志物 统计分析患者临床技术参数与ctDNA中EGFR的突变丰度关系(表1),结果显示,随着TNM分期的增加,ctDNA中EGFR突变丰度也逐渐增加,在T分期和N分期患者ctDNA中EGFR的突变丰度差异无统计学意义(P>0.05);
M分期中,有远处转移与无远处转移患者ctDNA中EGFR的突变丰度差异有统计学意义(P<0.05)。不同病理分期、发生脑转移、发生骨转移ctDNA中EGFR的突变丰度差异有统计学意义(P<0.05)。Ⅳ期的44例患者中发生骨转移和脑转移患者分别为(45.4%,20/44)和(36.4%,16/44),有无脑转移(图3A)和骨转移(图3B)患者ctDNA中EGFR突变丰度差异有统计学意义(P<0.05)。进一步分析发生多部位转移与ctDNA中EGFR突变丰度的相关性,结果显示,两者存在较强的相关性(r=0.510,P<0.001)(图3C)。
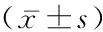
表1 临床技术参数与患者ctDNA中EGFR突变丰度的关系Table 1 Relationship between clinical and technical parameters and EGFR mutation abundance in ctDNA of patients

图3 脑、骨和转移位点数与ctDNA中EGFR突变丰度的关系A.脑转移;
B.骨转移;
C.转移位点数Figure 3 Relationship between the number of the brain, bone and metastatic site and EGFR mutation abundance in ctDNA
2.4ctDNA中EGFR突变的存在可能是肺腺癌预后较差的标志 分析102例肺腺癌患者ctDNA中EGFR突变的存在对预后的影响。结果显示:102例患者中,ctDNA中EGFR突变阴性66例(64.7%),血浆ctDNA中EGFR突变阳性36例(35.3%)。Kaplan-Meier生存曲线分析显示,肺腺癌患者的中位无进展生存时间(progression-free survival,PFS)为23.0个月(95%CI:14.6~27.4个月),其中ctDNA阳性组PFS明显短于ctDNA阴性组(13.8个月vs.42.2个月,P<0.05,log-rank检验)(图4A);
总生存期(overall survival,OS)平均时间为(59.2±3.4)个月(95%CI:50.0~64.8个月),ctDNA阳性组OS短于ctDNA阴性组[(34.4±3.40)个月vs.(66.8±1.78)个月,P<0.05,log-rank检验)](图4B)。此外,对38例组织样本诊断为EGFR敏感突变阳性并接受EGFR-TKIs治疗的肺腺癌患者进行亚组分析,显示38例患者中,ctDNA中EGFR阳性29例,EGFR阴性9例。统计分析显示:接受EGFR-TKIs治疗的患者中位PFS时间为18.0个月(95%CI:10.26~22.8个月),其中ctDNA中EGFR阳性组中位PFS比ctDNA阴性组短12个月(12.0个月vs.24.0个月,P<0.05,log-rank检验)(图4C)。综上所述,肺腺癌患者ctDNA中EGFR的存在提示较差的生存率和较差的EGFR-TKI治疗效果。

图4 ctDNA中EGFR突变与肺腺癌患者预后的关系A.ctDNA阳性组PFS明显短于ctDNA阴性组;B.ctDNA阳性组OS短于ctDNA阴性组;C.接受EGFR-TKIs治疗中ctDNA中EGFR阳性组中位PFS比ctDNA阴性组短Figure 4 Relationship between EGFR mutation in ctDNA and prognosis of patients with lung adenocarcinoma
近年来,随着各类靶向药物的发展,肺癌的治疗取得重大突破,而对患者治疗过程的全流程监控是十分必要的。大量研究表明,“液态活检技术”能够实时监测肿瘤的进展[4]。“液态活检”主要包括循环肿瘤细胞CTCs、外泌体和ctDNA,ctDNA是指携带肿瘤特定突变信息的血浆游离DNA,是由肿瘤细胞脱落或者凋亡之后释放到血液循环系统的DNA片段[5]。血液中肿瘤ctDNA所含的基因突变信息与肿瘤组织具有高度一致性,且ctDNA在肿瘤患者体内含量低,约占血浆游离DNA的1%,其半衰期短,有赖于多重PCR,数字PCR及二代测序技术的进步,ctDNA已在临床上得到广泛的应用[6]。多项研究表明,ctDNA在Ⅰ期癌症患者检出率为47%,在Ⅱ、Ⅲ、Ⅳ期癌症患者检出率分别是55%、69%和82%[7-8],说明ctDNA与肿瘤进展相关[9]。在晚期肺癌患者的胸腔积液、脑脊液和外周血中均能检测到EGFR、c-MET及ALK等基因的相关突变。
本研究主要探讨了ddPCR技术在检测肺腺癌患者血ctDNA中EGFR突变中的应用,比较早期和晚期肺腺癌的ctDNA检出率。结果表明,ddPCR技术仅在晚期肺癌有用,因为早期肺癌ctDNA检出率相对较低;
基于ddPCR技术的ctDNA基因分型检测的使用与癌症分期相关。既往研究已经发现ctDNA与肿瘤TNM分期相关。Joo等[10]报道ctDNA与原发肿瘤大小无关,但与转移部位数量显著相关。Couraud等[11]指出,ctDNA浓度与肿瘤期和转移部位数量显著相关。Aldea等[5]研究表明,发生骨转移患者的ctDNA含量较高。本研究结果显示,ctDNA与患者远处转移显著相关,尤其是骨转移和脑转移。不区分EGFR基因突变类型情况下,ddPCR技术检测ctDNA中EGFR突变状态的AUC为0.694,敏感度为40.2%,特异度为88.6%,说明ddPCR技术用于检测ctDNA中EGFR突变是可行的。在此基础上,进一步分析ddPCR技术检测ctDNA中EGFR的突变与肿瘤临床分期与TNM分期的关系,结果显示ddPCR技术检测晚期患者ctDNA中EGFR突变的AUC为0.837,且在M期及发生骨转移或脑转移肺腺癌患者中,ctDNA中EGFR突变丰度较高。最近的研究表明,在接受EGFR-TKIs治疗的晚期NSCLC患者中,ctDNA中EGFR基因突变差存在提示较长的PFS和OS。本研究结果显示,ctDNA中EGFR基因突变的存在提示着肺腺癌患者有较差的PFS和OS。此外,ctDNA中EGFR突变的存在提示晚期肺癌患者EGFR-TKIs治疗的疾病控制时间较短。ctDNA中的EGFR突变提示NSCLC患者接受EGFR-TKIs治疗有较差的PFS和OS,表明ctDNA中EGFR突变的存在预示着较差的预后[12-15]。
综上所述,利用ddPCR技术对ctDNA中EGFR基因突变分析是一种高度敏感度和特异度的检测方法,尤其适用于晚期非小细胞肺癌患者。ctDNA中EGFR突变是预测EGFR-TKIs疗效及患者有无远处转移和不良反应的生物标志物。
猜你喜欢敏感度腺癌肺癌中医防治肺癌术后并发症保健医苑(2023年2期)2023-03-15对比增强磁敏感加权成像对肺癌脑转移瘤检出的研究中国临床医学影像杂志(2022年2期)2022-05-25全体外预应力节段梁动力特性对于接缝的敏感度研究工程与建设(2019年5期)2020-01-19电视台记者新闻敏感度培养策略新闻传播(2018年10期)2018-08-16益肺解毒方联合顺铂对人肺腺癌A549细胞的影响中成药(2018年7期)2018-08-04在京韩国留学生跨文化敏感度实证研究海外华文教育(2016年2期)2017-01-20HIF-1a和VEGF-A在宫颈腺癌中的表达及临床意义西南军医(2016年3期)2016-01-23microRNA-205在人非小细胞肺癌中的表达及临床意义医学研究杂志(2015年12期)2015-06-10GSNO对人肺腺癌A549细胞的作用中国当代医药(2015年17期)2015-03-01基于肺癌CT的决策树模型在肺癌诊断中的应用郑州大学学报(医学版)(2015年1期)2015-02-27