任文鑫,马艺宸,高 鸿,唐 剑,黄岁岁,刘艳秋
(1.贵州医科大学,贵州 贵阳 550025;
2.贵阳市第四人民医院,贵州 贵阳 550007;
3.贵州医科大学附属医院,贵州 贵阳 550004)
再灌注心律失常(Reperfusion arrhythmia,RA)是指冠状动脉内血栓形成后自溶或药物溶栓、经皮冠状动脉腔内成形术(PTCA)等方法使闭塞的冠状动脉再通及冠状动脉痉挛的缓解等恢复心肌再灌注所致的心率失常。它常发生在冠状动脉再通的瞬间,严重时可引起血流动力学紊乱、甚至猝死[1]。缝隙连接蛋白43(Connexin 43,Cx43)是心脏中表达最丰富的亚型。缝隙连接是介导相邻细胞间离子和小分子信号物质直接交换的跨膜通道,心室肌细胞中主要表达为连接蛋白43(Cx43), 缝隙连接蛋白在维持心肌细胞的连接通讯功能、电信号传导和正常的节律性的收缩中起重要作用。Cx43由382个氨基酸组成,多种磷酸化作用和蛋白质结合的位置在其C末端,各类蛋白的主要差别在于羧基的末端和胞内环部分,决定其所组成的缝隙不同的理化性质、调节特性以及功能。连接蛋白与心律失常、心肌细胞损伤等心脏功能、生理、生化和病理的改变有着密切联系。大量研究指出Cx43可通过细胞内钙超载、氧自由基堆积和心肌细胞凋亡等参与RA发生和病情发展[2]。文献指出再灌注心律失常的发生机制与Cx43的表达下调和分布紊乱有关[3]。Cx43缺血再灌注损伤后表达下调会导致传导速(Conduction Velocity,CV)下降和性质改变,有效不应期(Effective refractory period,ERP)延长增加心律失常风险,均会诱导心律失常[4-5]。激发波长(λ)是传导速度和有效不应期(ERP)的函数,二者改变增加心律失常风险。内关穴是针灸治疗心血管疾病的首选穴位,研究表明电针后处理可减少再灌注心律失常的发生和保护心肌免受缺血再灌注损伤[6-8],但其具体的电生理机制有待探讨。因此,本研究通过建立大鼠心肌缺血再灌注损伤模型,观察电针后处理对大鼠缺血再灌注心室肌电传导和Cx43的影响,为临床防治 RA 提供参考。
1.1 实验动物
健康成年清洁级雄性斯泼累格·多雷(Sprague Dawley,SD)大鼠24只,体质量280~320 g,3~4月龄,由贵州医科大学实验中心提供[合格证号:SYK(黔)2018-00001]。入组SD大鼠标准饲料喂养,实验室房间内灯(4W白炽灯)每12 h明暗自动切换,环境温度设置为(23±2)℃,湿度(55±15)%;
饲养5 d后投入实验中。
1.2 心肌缺血再灌注损伤模型制备
腹腔注射戊巴比妥钠50 mg/kg(江苏万邦生物股份有限公司)麻醉SD 大鼠后仰卧位固定于手术台,连接相应电极,采用BL-420F生物机能实验系统记录Ⅱ导联心电图以及手术过程的生命体征。调节呼吸参数(频率45~60次/min,潮气量20 mL/kg,吸呼比1∶1.5)后建立呼吸支持。在胸骨左缘心尖搏动最强处取纵形切口,暴露心脏,在左心耳与肺动脉圆锥下缘2~3 mm处用6.0 号丝线结扎冠状动脉左前降支(LAD)[9]。结扎后观察心电图II导联,若 ST 段抬高、T波高耸及心脏表面苍白或紫绀则表明缺血模型建立成功。建立急性缺血再灌注损伤模型成功后,缺血30 min后剪开丝线,再灌注30 min。心脏表面苍白或紫绀区变红则说明再灌注成功。
1.3 电针“内关”穴干预
根据大鼠实验图谱定位“内关”穴(腕到肘间下1/6处前肢内侧), 距腕关节约3 mm的尺桡骨缝间[10]。在大鼠双前肢内关穴处使用0.30 mm×25 mm一次性无菌针灸针直刺2~3 mm,接华佗牌电针仪(苏州医疗用品有限公司)并按照疏密波、频率1~2 Hz、电流强度2 mA和负载电压1 mv的标准调节电针仪,在再灌注期间电针干预30 min[11](干预有效的标准:双前肢出现轻微颤动)。
1.4 实验分组
根据实验目的将大鼠随机分为3组(n=8):假手术(Sham operation,SH)组大鼠开胸后只穿线不结扎冠状动脉;
缺血再灌注(Ischemia reperfusion,IR)组开胸结扎冠状动脉30 min,开放冠状动脉后再灌注30 min;
电针(Electroacupuncture,EA)组开胸后结扎冠状动脉30 min,再灌注即刻电针干预大鼠双上肢内关穴30 min。
1.5 心室肌电传导及心律失常的观察
在左心室游离壁上放置铂刺激电极,刺激电极安置在距记录电极3 mm的左心室心尖外膜处,另一刺激电极放置于右心耳,BL-420F生物机能实验系统记录有效不应期(ERP)、激动潜伏期(刺激波起点和MAP峰值的时间间隔)、传导速度CV=3 mm/激动潜伏期)和心电图。采用 DF-5A心脏刺激仪(上海奥尔科特生物科技有限公司)行程控刺激。激发波长是CV和ERP的函数(λ=ERP×CV),反映了功能性连接蛋白表达量。连续发放8个起搏刺激波S1后,发放1个期前收缩波S2,设定S1S2为250 ms,每次减少10 ms至S2不能诱发动作电位,将S1S2增加10 ms,以1 ms负扫至S2不能诱发动作电位,即此刻S1S2间期为ERP。记录冠状动脉结扎前(T0)、缺血30 min(T1)、再灌注30 min(T2)各时点的HR和T2的传导速度(CV)、有效不应期(ERP)、激发波长(λ)和心律失常评分[12]。参考 Curist-Walker评分标准进行心律失常评分:①0分:<10次室性早搏(VPB);
②1分:>10次VPB;
③2分:1~5 次室性心动过速(VT);
④3分:>5次VT或者1次室颤(VF)(VT和VF总共持续时间<40 s);
⑤4分:由VT转化的VF 2~5次,且VF持续时间总和<80 s;⑥5分:由VT转化为VF>5次,且VF持续时间总和<160 s;⑦6分:VT和VF总共持续时间<300 s;⑧7分:VT和VF总共持续时间>300 s。
1.6 免疫组织化学法检测Cx43分布和表达
成功获取左心室心肌组织进行常规脱水、透明和石蜡包埋,制备切片,二甲苯(江苏万邦生物股份有限公司)脱蜡,梯度乙醇脱水,枸橼酸缓冲液(江苏万邦生物股份有限公司)煮沸修复,3%双氧水(江苏万邦生物股份有限公司)封闭20 min,山羊血清37 ℃封闭20 min;
加入兔抗大鼠Cx43多克隆抗体(稀释度1∶200,北京博奥森生物技术有限公司),4 ℃孵育过夜;
加入生物素标记的羊抗兔 IgG抗体(稀释度1∶200,北京博奥森生物技术有限公司),37 ℃孵育20 min;
加入辣根过氧化物酶标记的链酶亲和素(江苏万邦生物股份有限公司),37 ℃孵育20 min;
DAB显色,脱水,封片;
光镜下观察Cx43分布。
1.7 免疫印迹法(Western blotting)检测Cx43蛋白的表达
成功获取大鼠左心室心尖处组织后按照说明加入恰当的细胞裂解液及蛋白酶抑制剂(PMSF)(上海碧云天公司),冰上匀浆,采用BCA蛋白浓度测定试剂盒(上海碧云天公司)定量。
据分子量大小,制备12%分离胶和5%浓缩胶,上层胶电压80 V下层胶电压120 V进行电泳,200 mA恒电流转膜2 h,用封闭液封闭2 h,孵育一抗(Cx43抗体,1∶8 000,Abcam公司,英国)4 ℃过夜,次日采用辣根过氧化物酶标记的二抗(1∶10 000,Abcam公司,英国)室温孵育1 h。
ECL显色曝光,显影,并以内参GAPDH蛋白条带灰度值为标准,计算Cx43蛋白的相对含量。
1.8 统计学处理

2.1 3组大鼠在不同时点的HR比较
与T0比较,IR组和EA组在T1、T2时HR均明显减慢,差异具有统计学意义(P<0.05),与T1比较,IR组及EA组在T2时的HR明显增加,差异具有统计学意义(P<0.05)。与SH组比较,IR组和EA组在T1、T2时HR均显著降低,差异具有统计学意义(P<0.05);
与IR组比较,EA组的HR在T2时点增加,差异具有统计学意义(P<0.05)。T0时点在SH组、IR组及EA组的HR差异无统计学意义(P>0.05)。SH组在T0、T1和T2时的HR差异均无统计学意义(P>0.05)。见表1。

表1 3组大鼠在不同时点的HR比较
2.2 3组大鼠在不同时点的MAP比较
与T0比较,IR组和EA组在T1、T2时点MAP下降(P<0.05),SH组在T2时降低,差异具有统计学意义(P<0.05);
与T1比较,EA组在T2时MAP增加,差异具有统计学意义(P<0.05)。与SH组比较,IR组和EA组在T1和T2时MAP 降低,差异具有统计学意义(P<0.05);
与IR组比较,EA组在T2时MAP增加,差异具有统计学意义(P<0.05)。各组MAP在T0时差异无统计学意义,在T1时,EA组与IR组比较差异无统计学意义。见表2。

2.3 3组大鼠在T2时CV、ERP、λ和心律失常评分比较
与SH组比较,IR组与EA组的CV、ERP及λ减慢,心律失常评分增高,差异具有统计学意义(P<0.05);
与IR组比较,EA组的CV、ERP及λ增加,心律失常评分降低,差异具有统计学意义(P<0.05)。见表3。

2.4 3组大鼠在T2时Cx43分布和表达的影响
免疫组织化学染色结果显示,Cx43染色阳性均呈棕黄色,分布在细胞膜和细胞质。与SH组比较,IR组和EA组的Cx43表达明显下调,差异具有统计学意义(P<0.05),分布紊乱、无规则;
与IR组比较,EA组的Cx43表达上调,分布较规则。
利用Western blot法检测Cx43蛋白的表达。结果表明,与SH组比较,IR组和EA组的Cx43表达明显下降,差异具有统计学意义(P<0.05);与IR组比较,EA组的Cx43表达上调,差异具有统计学意义(P<0.05)。见图1~2和表4~5。

注:通过Image J对Cx43图像进行定量分析。图1 3组大鼠通过免疫组织化学观察Cx43表达和分布(400×)

图2 3组大鼠通过Western blot观察Cx43蛋白表达
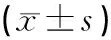
表4 3组大鼠Cx43平均灰度值(AOD)结果
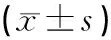
表5 3组大鼠Cx43蛋白表达
本研究通过建立心肌缺血再灌注损伤模型探讨电针内关穴对大鼠缺血再灌注心室肌电传导和Cx43的影响。使用的造模方法是目前常用的制备心肌缺血损伤的方法。通过心电图ST段抬高,再灌注心率失常评分增高的结果可表明心肌缺血再灌注损伤模型建立成功。
针灸是中医的重要组成部分,内关穴是传统中医治疗心血管疾病的首选穴位,研究报道针灸内关穴对心律失常具有双向调节作用[11-12]。内关穴是手厥阴心包经的络穴,对心肌缺血再灌注损伤具有保护作用[13],电针预处理可改变全基因组基因表达,保护大鼠心肌免受I/R损伤,这很可能是通过神经体液调节实现的。可通过各种机制降低RA的发生。另研究报道电针深浅内关穴可通过上调Cx43表达和改善Cx43分布紊乱改善心律失常。因此本研究通过建立大鼠在体缺血再灌注损伤模型,观察电针内关穴后处理对缺血再灌注心室肌的电传导的影响[14]。
心肌电传导异常和电兴奋异常可导致心律失常。有效不应期(ERP)可反应心肌细胞的电兴奋性,ERP的形成与心肌的Na2+通道密切相关,Na2+通道开发延迟,ERP延长,细胞兴奋性和细胞膜再去极化能力减弱,最终增加心律失常的风险[15]。CV 是电极间距离与激活潜伏期的比值,CV减慢提示心肌细胞间传导减慢及电耦联能力下降,电传导障碍可导致折返性心律失常[3]。Cx43蛋白由GJA1编码,负责细胞间的通讯传导和电兴奋活动的传导。钙/钙调蛋白依赖的蛋白激酶在缺血再灌注损伤的病理状态下激活电压门控钙通道,增加心肌细胞Ca2+内流,引起钙超载,最终导致心律失常。CaMKII是Cx43在心肌闰盘上准确定位和发挥电传导功能的重要原因,抑制此信号通路会增加Cx43在闰盘上定位,改善心肌细胞间的电传导,防止诱发RA[16]。这说明Cx43或许通过CaMKII影响细胞内钙离子内流,减少RA的发生。大量的研究也指出Cx43在缺血再灌注损伤时表达下调、磷酸化状态改变,引起心肌细胞间离子流改变,引起电通讯异常或电传导减慢[17-18],最终增加RA易感性[19]。在既往文献中,有单侧和双侧“内关”穴电针的研究,相较于单侧“内关”穴电针,对于双侧“内关”穴电针可以更好地促进心肌功能的恢复,并且通过调整相关因子的表达来发挥对心肌组织的恢复,当然只存在于动物实验中[20]。本研究结果表明,IR组会使大鼠HR、CV、 ERP、λ和Cx43的表达明显降低,心律失常评分增加,EA组的ERP、CV、λ及Cx43的表达明显增加,心律失常评分降低,这表明电针后处理可通过改善CaMKII增加Cx43在闰盘上的定位以及降低缺血再灌注损伤对心肌Na2+通道的抑制,增加心肌细胞间的电传导和电兴奋,减少再灌注心律失常的发生,但具体的调节机制需要进一步的实验验证。
综上所述,电针后处理降低再灌注心律失常的发生机制可能与上调Cx43的表达、增加心肌电传导和电兴奋性有关。
猜你喜欢电针传导心肌细胞左归降糖舒心方对糖尿病心肌病MKR鼠心肌细胞损伤和凋亡的影响世界科学技术-中医药现代化(2022年2期)2022-05-25活血解毒方对缺氧/复氧所致心肌细胞凋亡的影响世界科学技术-中医药现代化(2021年7期)2021-11-04神奇的骨传导小学科学(学生版)(2019年10期)2019-11-16“散乱污”企业治理重在传导压力、抓实举措中国环境监察(2017年5期)2017-10-23心肌细胞慢性缺氧适应性反应的研究进展海南医学(2016年8期)2016-06-08基于开关电源的传导抗扰度测试方法电测与仪表(2016年14期)2016-04-11槲皮素通过抑制蛋白酶体活性减轻心肌细胞肥大中国病理生理杂志(2015年8期)2015-12-21电针改善脑卒中患者膝过伸的效果中国康复理论与实践(2015年7期)2015-05-09低频电针治疗多囊卵巢综合征30例中国中医药现代远程教育(2014年11期)2014-08-08电针及高频热疗机治疗腰椎间盘突出症85例中国中医药现代远程教育(2014年11期)2014-08-08