许琼冠,欧阳一彬,谢镇明
术后认知功能障碍(POCD)是全身麻醉后影响中枢神经系统的常见并发症之一。POCD可延长术后的恢复时间,并长期影响病人的生活质量。60岁以上病人POCD发生率较高,严重影响了老年病人的生活能力和生活质量[1]。有研究表明,年龄增加、大手术、心肌梗死史、酒精依赖史、既往存在认知功能障碍为POCD的独立危险因素[2]。虽然POCD发病机制尚未明确,先前研究表明,炎症反应、氧化应激、蛋白表达变化、细胞凋亡和中枢胆碱能系统的退化可能是POCD发病的因素[3-4]。迫切需要了解导致POCD的潜在机制,并找到有效的方法保护术后认知功能。酪氨酸激酶2(JAK2)/转录激活因子3(STAT3)通路参与较多生理过程,包括炎症、增殖、分化和发育[5],可能有助于驱动暴露于细胞因子后神经元的存活反应。有研究证实,JAK2/STAT3通路参与了短暂性局灶性脑缺血后的抗凋亡过程[6]。阿尔茨海默病动物模型中,激活JAK2/STAT3通路改善了空间学习和记忆功能[7]。MicroRNA(miRNA)是一类短链非编码RNA,通过mRNA降解或翻译在抑制靶基因表达中发挥关键作用。目前,在哺乳动物的脑组织中发现了大量的miRNA,其与脑组织发育、神经元分化和高级神经功能(如学习和记忆)有关[8],同时与神经退行性疾病、精神障碍和脑肿瘤等疾病有关[9]。相关研究显示,在阿尔茨海默病和帕金森病中,miRNA参与调节神经元细胞周期控制和凋亡[10],同时参与调节缺血后脑损伤的病理过程[11]。miR-433位于12号染色体上,有研究显示,miR-433在缺氧条件下可调节神经元的增殖和迁移[12],提示miR-433在调节神经细胞生物学功能方面具有重要作用。miR-433在POCD的神经发病机制中的作用尚未明确。本研究探讨miR-433和JAK2/STAT3信号通路在大鼠术后认知障碍中的确切作用和相关机制。
1.1 实验试剂与仪器 SYBR Premix Ex Taq试剂盒(北京优尼康生物科技有限公司);
PrimeScript RT Reagent Kit试剂盒、miRcute miRNA cDNA第一链合成试剂盒[宝日医生物技术(北京)有限公司];
原位末端凋亡(TUNEL)染色试剂盒(Roche公司);
ABI 7500聚合酶链式反应(qPCR)系统(Applied Biosystems公司);
BX51显微镜(奥林巴斯公司)。
1.2 实验动物 8周龄雄性SD大鼠,体质量500~600 g,饲养于动物房中(由海南医学院实验动物中心提供),温度为22~24 ℃,湿度为55%~65%,光照/黑暗周期为12 h,并提供食物和水。所有实验方案和程序均获得医院动物伦理委员会批准。
1.3 POCD大鼠模型的建立和实验分组 将大鼠随机分为Control组、POCD组、POCD+NC mimic组、POCD+miR-433 mimic组。术前禁食12 h,大鼠吸入异氟醚(1.5%~2.0%)麻醉,进行气管插管和机械通气。整个手术过程中暴露在21%O2、79%N2和1.5%~2.0%异氟醚的混合物中进行麻醉。消毒后,在剑突下缘垂直切开3 cm,解剖左肝叶。探查左肝叶并与根部结扎,随后切除。使用0.25%布比卡因浸润切口,3-0缝线缝合。待大鼠恢复意识后,将其送回到动物房。一旦建立大鼠POCD模型,POCD+NC mimic组、POCD+miR-433 mimic组、POCD+miR-433 mimic+Vector组和POCD+miR-433 mimic+pcDNA-JAK2组大鼠分别通过脑室注射将总体积为 2 μL的NC mimic、miR-433 mimic及Vector、pcDNA-JAK2慢病毒注射到海马中。Control组和POCD组大鼠未接受病毒载体。
1.4 方法
1.4.1 莫里斯水迷宫实验(Morris) 使用Morris水迷宫实验评估认知功能。于损伤后5~8 d进行,训练持续4 d,每日5次实验。迷宫由一个不锈钢圆形水池(直径120 cm,高50 cm)组成,将水池分为4个象限,在西南象限的中央放置一个透明的有机玻璃平台。将大鼠从4个象限中的一个放入水中自由游泳,探索迷宫,直至找到平台。若大鼠在60 s内找不到平台,将其放置在平台上休息10 s。第5天,移除平台,将大鼠从东北象限放入水中,让其游泳60 s,记录大鼠逃避潜伏期、穿越平台次数。
1.4.2 苏木精-伊红(HE)染色 使用35 mg/kg戊巴比妥钠麻醉大鼠,解剖大鼠分离脑组织样本。将脑组织置入4%多聚甲醛中固定24 h,进行常规石蜡包埋。将组织切成厚度为5 μm的连续冠状切片,之后脱蜡再水合。使用HE染色试剂盒对脑组织进行染色,在光学显微镜下观察脑组织病理变化。
1.4.3 TUNEL染色 按照制造商说明书,使用TUNEL染色试剂盒进行染色。将切片与包括TdT酶和TMRred标记的dUTP在内的TUNEL反应混合物在37 ℃下避光孵育1 h,之后洗涤15 min,使用含有0.03%的3,3′-二氨基联苯胺(DAB)的转化过氧化物酶可视化。在BX51显微镜下观察和计数每个切片的5个视野下TUNEL阳性细胞总数。
1.4.4 实时荧光定量PCR(RT-qPCR) 使用Trizol试剂从海马组织中提取总RNA。之后用PrimeScript RT Reagent Kit试剂盒和miRcute miRNA cDNA第一链合成试剂盒分别从mRNA和miRNA中反转录合成cDNA。使用SYBR Premix Ex Taq试剂盒在ABI 7500 qPCR系统上进行PCR反应。反应条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,重复40个循环。采用2-ΔΔCt法计算miRNA和mRNA基因的相对表达,U6和GAPDH分别作为miRNA和mRNA的内部对照。
1.4.5 酶联免疫吸附(ELISA)实验 收集海马组织,采用RIPA法分离蛋白,采用二喹啉甲酸法(BCA)试剂盒测定蛋白浓度。根据ELISA试剂盒说明书检测超氧化物歧化酶(SOD)和丙二醛(MDA)水平,使用酶标仪测量450 nm波长各孔的吸光度值。
1.4.6 蛋白免疫印迹法(Western Blot) 使用RIPA裂解液对处理后的海马组织进行分裂,采用BCA试剂盒检测蛋白浓度。将50 g蛋白样品通过8%~12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转移到聚偏二氟乙烯(PVDF)膜上。将膜在含5%脱脂牛奶的PBST缓冲液中于37 ℃封闭1 h,并与一抗在4 ℃下孵育过夜。之后将膜与相应的辣根过氧化物酶结合的二抗在37 ℃下孵育1 h。使用电化学发光(ECL)试剂盒测量相关蛋白表达水平,并使用Image J软件进行定量。
1.4.7 双荧光素酶报告基因实验 将293 T细胞接种在24孔板中,并与携带野生型JAK2(WT-JAK2)或突变型JAK2(MUT-JAK2)的荧光素酶质粒和miR-433 mimic或NC mimic共转染。孵育48 h后,根据说明书采用双荧光素酶报告基因检测试剂盒检测荧光强度。
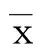
2.1 miR-433对POCD大鼠认知能力的影响 与Control组比较,POCD组大鼠海马组织中miRNA-433表达降低,逃避潜伏期延长,穿越平台次数减少;
与POCD+NC mimic组比较,POCD+miR-433 mimic组大鼠海马组织中miRNA-433表达升高,逃避潜伏期缩短,穿越平台次数增加,差异均有统计学意义(P<0.05)。详见图1。

POCD组与Control组比较,*P<0.05;
POCD+miR-433 mimic组与POCD+NC mimic组比较,#P<0.05。图1 miR-433对POCD大鼠认知功能的影响(A为miRNA-433表达柱状图;
B为逃避潜伏期柱状图;
C为穿越平台次数柱状图)
2.2 miR-433对POCD大鼠海马组织病理学的影响 HE染色结果显示:Control组海马组织神经细胞排列规则紧密,细胞边界清晰,细胞核呈圆形或椭圆形。POCD组神经细胞紊乱,细胞核溶解,海马神经元细胞和锥体细胞死亡,坏死神经细胞数量减少。POCD+miR-433 mimic组大鼠海马内细胞排列较POCD+NC mimic组更规则,坏死神经细胞数量减少。详见图2。

图2 miR-433对POCD大鼠海马组织病理学变化的影响(HE)
2.3 miRNA-433过表达对神经元细胞凋亡的影响 与Control组比较,POCD组大鼠神经元细胞凋亡率、Cleaved Caspase-3和Bad蛋白表达升高,Bcl-2蛋白表达降低;
与POCD+NC mimic组比较,POCD+miR-433 mimic组大鼠神经元细胞凋亡率、Cleaved Caspase-3和Bad蛋白表达降低,Bcl-2蛋白表达升高,差异均有统计学意义(P<0.05)。详见图3。

POCD组与Control组比较,*P<0.05;
POCD+miR-433 mimic组与POCD+NC mimic组比较,#P<0.05。图3 miR-433对POCD大鼠神经元细胞凋亡的影响(A为TUNEL染色图;
B为细胞凋亡率柱状图;
C为各蛋白表达条带图;
D为各蛋白表达柱状图)
2.4miRNA-433过表达对POCD大鼠海马组织氧化应激水平的影响 与Control组比较,POCD组大鼠海马组织SOD水平降低,MDA水平升高,差异均有统计学意义(P<0.05);
与POCD+NC mimic组比较,POCD+miR-433 mimic组大鼠海马组织SOD水平升高,MDA水平降低,差异均有统计学意义(P<0.05)。详见图4。

POCD组与Control组比较,*P<0.05;
POCD+miR-433 mimic组与POCD+NC mimic组比较,#P<0.05。图4 miR-433对POCD大鼠海马组织氧化应激水平的影响 (A为MDA表达柱状图;
B为SOD表达柱状图)
2.5 miR-433靶向JAK2并调控其表达 双荧光素酶报告基因实验结果显示,与NC mimic组比较,miR-433 mimic组WT-JAK2细胞荧光素酶活性降低(P<0.05);
RT-qPCR实验结果显示,与NC mimic组比较,miR-433 mimic组JAK2 mRNA和蛋白水平下降,差异均有统计学意义(P<0.05)。详见图5。

与NC mimic组比较,*P<0.05。图5 miR-433靶向JAK2并调控其表达(A为荧光素酶活性柱状图;
B为JAK2 mRNA表达柱状图;
C为JAK2蛋白表达条带图;
D为JAK2蛋白表达柱状图)
2.6 miR-433通过JAK2/STAT3通路对POCD大鼠氧化应激和凋亡的影响 与POCD+NC mimic组比较,POCD+miR-433 mimic组大鼠海马组织中p-JAK2、p-STAT3、Cleaved Caspase-3、Bad蛋白及MDA水平降低,Bcl-2蛋白、SOD水平升高;
与POCD+miR-433 mimic+Vector组比较,POCD+miR-433 mimic+pcDNA-JAK2组大鼠海马组织p-JAK2、p-STAT3、Cleaved Caspase-3、Bad蛋白及MDA水平升高,Bcl-2蛋白、SOD水平降低,差异均有统计学意义(P<0.05)。详见图6。

POCD+miR-433 mimic组与POCD+NC mimic组比较,*P<0.05;
POCD+miR-433 mimic+pcDNA-JAK2组与POCD+miR-433 mimic+Vector组比较,#P<0.05。图6 miR-433通过JAK2/STAT3通路对POCD大鼠氧化应激和凋亡的影响(A为各蛋白表达条带图;
B为Cleaved Caspase-3、Bad、Bcl-2蛋白表达柱状图;
C为p-JAK2、p-STAT3蛋白表达柱状图;
D为MDA表达柱状图;
E为SOD表达柱状图)
POCD主要临床表现为注意力、记忆、语言等认知功能减退。POCD的病理机制复杂,且尚未明确。在具有学习和记忆功能的大脑海马体中,信号通路的改变认为是全身麻醉导致POCD认知障碍的上游机制。据报道,异氟醚是一种常见的吸入麻醉剂,通过核转录因子(NF)-κB和缺氧诱导因子-1等多种途径诱导老年大鼠海马神经炎症和认知损伤[13]。氧化应激可能参与POCD的发病机制,有研究显示,手术创伤诱导了POCD模型鼠海马的氧化应激[14]。这些机制为POCD提供了潜在的预防或治疗靶点。已研究证实,在POCD大鼠模型中,抑制氧化应激可改善认知功能障碍[15]。本研究采用异氟醚诱导的大鼠POCD模型,通过测定氧化应激因子、细胞凋亡和JAK2/STAT3信号通路相关蛋白,探讨miR-433在大鼠POCD发生和进展中的作用,本研究提供了一种新的POCD治疗方法,并探讨其作用机制。
Morris水迷宫实验常用于评估大鼠认知功能,主要是实验动物空间位置和方向学习记忆能力,广泛应用于学习记忆、老年痴呆、海马研究、智力与衰老、新药研发等方面的研究[16]。逃逸潜伏期用于评估大鼠学习能力,逃逸潜伏期越短,表现越好。穿越平台次数用于评估空间记忆能力,穿越平台次数越多提示性能水平越高。本研究将miR-433过表达腺病毒注射至大鼠体内,结果显示,miR-433过表达改善了POCD大鼠学习和空间记忆能力。
本研究结果显示,miR-433过表达与海马MDA降低和SOD水平升高有关,表明miR-433过表达抑制了老年POCD大鼠海马的氧化应激。氧化应激是指抗氧化防御系统功能障碍,导致活性氧和活性氮过量产生,从而导致组织和细胞损伤[17]。SOD是抗氧化系统中重要的酶,其活性可直接反映线粒体抗氧化系统水平[18]。有研究表明,氧化应激参与了POCD诱导的神经元损伤[1]。有研究显示,手术创伤可诱导POCD海马氧化应激,从而参与POCD发病机制,年龄也是POCD的危险因素,年老的海马表现出多种神经生物学变化,包括氧化应激增加[19]。因此,氧化应激可能是治疗POCD的潜在靶点。有研究表明,miR-7684参与调控POCD氧化应激的表达[20]。本研究中,miR-433过表达可降低POCD大鼠氧化应激,抑制神经元凋亡,改善术后认知功能障碍的发生和发展,发挥神经保护作用。
相关研究显示,JAK2/STAT3信号通路在脑缺血神经元中具有抗炎和抗凋亡作用[21]。JAK2磷酸化或过表达可能是脑损伤的机制之一[22]。减少JAK2/STAT3磷酸化可减少神经元死亡,缩小梗死面积,防止神经细胞缺血后损伤。脑缺血后通过RNA干扰降低了STAT3磷酸化,具有显著的神经保护作用[23]。有研究显示,电针刺激大鼠局灶性脑缺血,通过降低JAK2表达,防止JAK2异常激活,下调STAT3磷酸化,从而改善神经功能缺损[24]。JAK2/STAT3通路下调与miRNA上调相关。miR-17通过靶向JAK2/STAT3信号通路,减少胶原诱导关节炎小鼠的炎症和骨侵蚀[25]。有研究显示,帕金森病和阿尔茨海默病病人miR-433下调,miR-433过表达可能通过JAK2/STAT3降低Aβ诱导的神经元活性抑制[26]。miR-433通过JAK2/STAT3通路在术后认知障碍中的作用尚未明确。本研究结果显示,miR-433过表达可能通过JAK2/STAT3通路改善大鼠POCD。
综上所述,miR-433通过JAK2/STAT3通路调控氧化应激抑制海马组织的神经元凋亡,改善大鼠认知功能,为治疗POCD提供了新方法。
猜你喜欢柱状图海马氧化应激海马作文周刊·小学二年级版(2022年20期)2022-05-05基于Unity3D 的冒泡排序算法动态可视化设计及实现喀什大学学报(2021年6期)2021-03-12基于炎症-氧化应激角度探讨中药对新型冠状病毒肺炎的干预作用世界科学技术-中医药现代化(2020年2期)2020-07-25海马创新作文(小学版)(2019年10期)2019-09-25“海马”自述小学生学习指导(低年级)(2017年5期)2017-05-04基于Android平台的柱状图组件的设计实现现代计算机(2016年16期)2016-10-18氧化应激与糖尿病视网膜病变西南军医(2016年6期)2016-01-23基于Excel-VBA的深水井柱状图绘制程序的设计和实现河南水利与南水北调(2015年22期)2015-08-19氧化应激与结直肠癌的关系西南军医(2015年2期)2015-01-22Mapgis在绘制钻孔柱状图中的应用化工矿产地质(2013年2期)2013-10-11